報名已截止,恕不接受現場報名,感謝大家盛情~
高醫大數據研究中心/附院臨床醫學研究部醫學統計分析及生物資訊研究室/附院臨床試驗中心-聯合舉辦2020年「臨床試驗統計」系列課程 (限高醫體系師生、醫護人員和職員工報名)
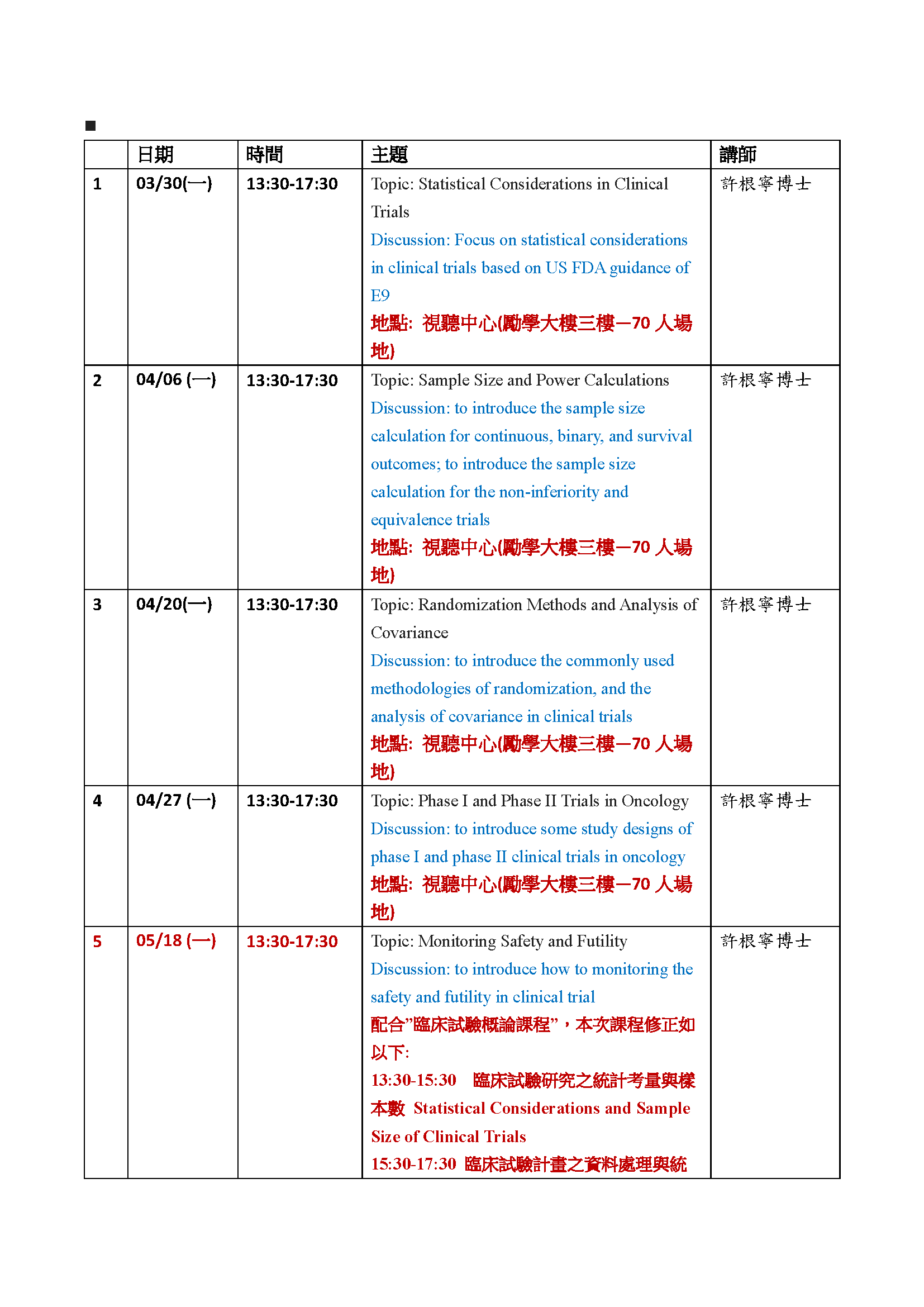
課程時間:03/30(一) 13:30-17:30
課程地點:視聽中心(勵學大樓三樓)
請注意!!! 為保障大家之健康,建議參加人員自備並全程配戴口罩,演講前於簽到處將協助測量額溫,請參加者盡量提早出席。不便之處,敬請見諒!
課程簡介
本課程主要在讓學生能夠對第一期到第三期臨床試驗的統計設計能夠有個初步的認識與了解。課堂內容主要參考Statistical Design and Analysis of Clinical Trials一書。本書目前是美國羅格斯大學(Rutgers University)生物統計系(Department of Biostatistics)的教科書。同時也是杜蘭大學(Tulane University)生物統計系的教科書,以及美商布萊特臨床醫學技術有限公司(Brightech International)統計部門指定要閱讀的書籍。
對於業界執行臨床試驗,法規單位對於臨床試驗設計也都有發佈相關的準則,像是美國食品藥物管理局(US Food and Drug Administration)發佈的General Considerations for Clinical Trials、Choice of Control Group and Related Issues in Clinical Trials、Clinical Trial Endpoint for the Approval of Cancer Drugs and Biologics、Non-inferiority Clinical Trials,和Multiple Endpoints in Clinical Trials等。課堂上也都會對美國與歐盟法規單位所發佈的準則做簡單的介紹與比較,了解美國與歐明法規單位對於臨床試驗統計設計有何規定與建議。
在介紹完臨床試驗統計設計以及法規的相關規定與建議,也會透過各藥廠實際的案例了解介紹的統計設計是如何地被實踐。
推薦參考書:
1. Shih W. J. and Aisner J. Statistical Design and Analysis of Clinical Trials. New York, Chapman and Hall; 2016
2. Dmitrienko A., Tamhane A., and Bretz F. Multiple Testing Problems in Pharmaceutical Statistics. New York, Chapman and Hall; 2009.
3. O’Kelly M. and Ratitch B. Clinical Trials with Missing Data: A Guide for Practitioners. New York, John Wiley & Sons; 2014.
4. Wassmer G. and Brannath W. Group Sequential and Confirmatory Adaptive Designs in Clinical Trials. New York, Springer-Verlag; 2016.
上課條件規定:
1.本課程僅限高醫體系師生、醫護人員和職員工報名
2. 需修習過基礎統計學
上課講師: 許根寧博士(上海藥明康德新藥開發有限公司首席統計師)
報名人數限制: 40位 (報名至3/27(五)或額滿為止)
備註1: 本系列課程屬於GCP課程,全程參與者需紙本報到簽到與結束簽退,如缺任何一項,將無法核發課程證書,敬請務必多加留意
備註2: 主辦單位依報名順序審核錄取並保有最終報名成功與否審核權,同時本課程申請教師成長點數中
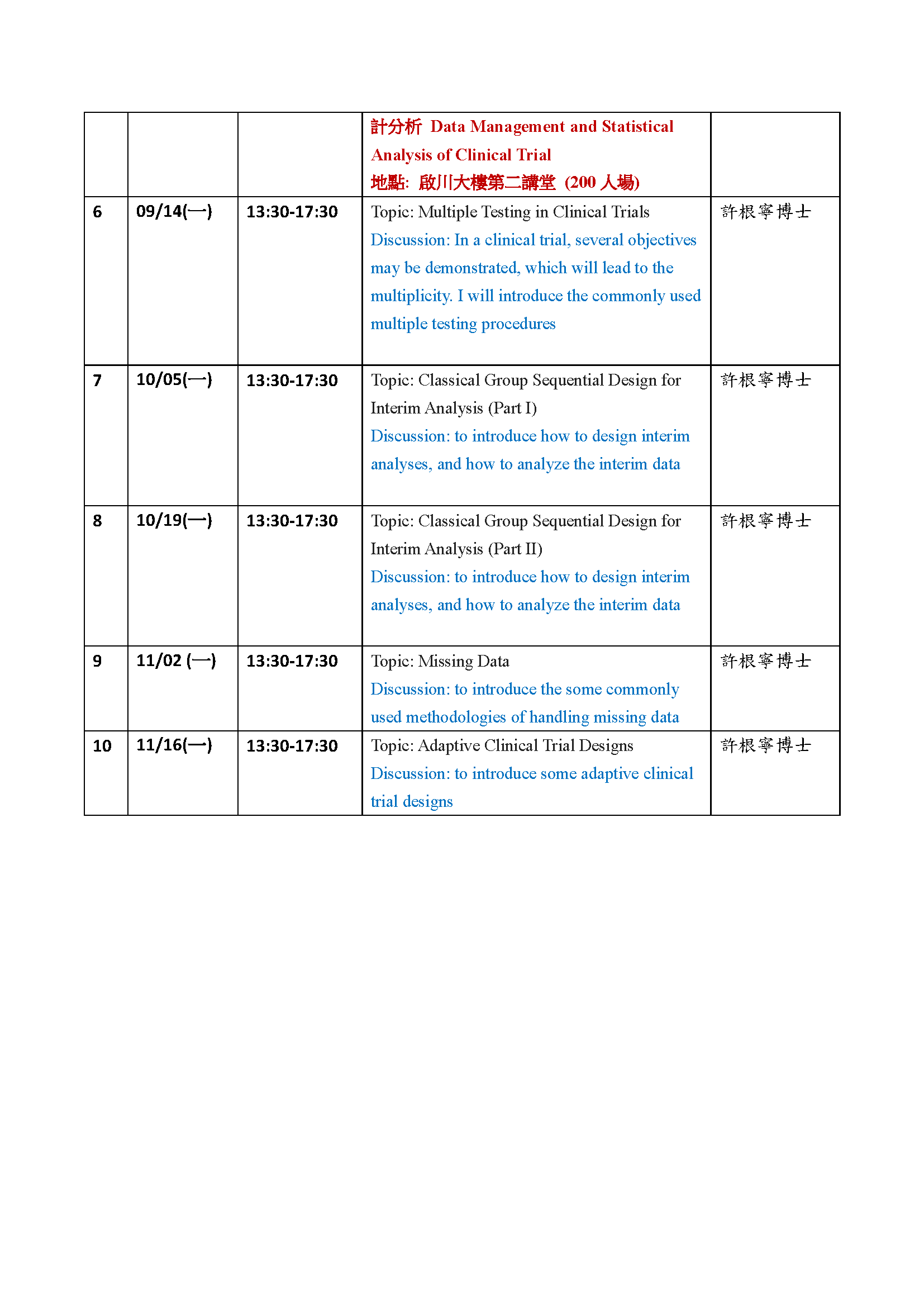
系列課程列表(後續課程內容可能會再依實際情況修改):